Inhaltsmenü
● Einführung in Calciumcarbid und Acetylengas
● Die chemische Reaktion zwischen Calciumcarbid und Wasser
>> Die grundlegende Reaktion
>> Reaktionsmechanismus
● Visuelle Darstellung der Reaktion
● Industrieproduktion von Acetylengas aus Kalziumkarbid und Wasser
>> Produktionsmethoden
>> Nassprozessdetails
>> Reaktionskontrolle und Sicherheit
● Faktoren, die die Reaktionsgeschwindigkeit und Gasausbeute beeinflussen
>> Experimentelles Datenbeispiel
● Anwendungen von Acetylengas, die aus Calciumcarbid erzeugt werden
>> Industrielle Verwendungszwecke
>> Andere Verwendungen
● Sicherheitsüberlegungen in der Acetylenproduktion
● Umweltauswirkungen und Nachhaltigkeit der Acetylenproduktion
● Innovationen und zukünftige Trends in der Acetylenproduktion
● Fehlerbehebung gemeinsame Probleme bei der Acetylenproduktion
● Zusammenfassung der wichtigsten Punkte
● Abschluss
● Häufig gestellte Fragen (FAQ)
>> 1. Welche Sicherheitsvorkehrungen sollten beim Umgang mit Calciumcarbid und Acetylengas getroffen werden?
>> 2. Kann Acetylengas ohne Kalziumkarbid hergestellt werden?
>> 3. Wie ist die Reinheit von Acetylengas gewährleistet?
>> 4. Was passiert mit dem in der Reaktion erzeugten Calciumhydroxid?
>> 5. Warum wird Acetylengas für das Schweißen über andere Gase bevorzugt?
● Zitate:
Calciumcarbid (CAC₂) ist eine wichtige chemische Verbindung, die in verschiedenen industriellen Anwendungen weit verbreitet ist, insbesondere für die Herstellung von Acetylengas (C₂H₂). Die Reaktion zwischen Calciumcarbid und Wasser ist ein klassisches und grundlegendes chemisches Verfahren, das Acetylengas und Calciumhydroxid (CA (OH) ₂) erzeugt. Dieser Artikel enthält eine umfassende Erklärung, wie Calciumcarbid reagiert mit Wasser, den chemischen Prinzipien hinter der Reaktion, den industriellen Produktionsmethoden, Sicherheitsüberlegungen und den Anwendungen von Acetylengas, die durch diesen Prozess erzeugt werden.

Einführung in Calciumcarbid und Acetylengas
Calciumcarbid ist eine feste kristalline Verbindung, die aus Calcium- und Kohlenstoffatomen besteht. Es wird industriell durch Erhitzen von Kalk (CAO) und Koks (Kohlenstoff) in einem elektrischen Bogenofen bei extrem hohen Temperaturen (~ 2000 ° C) hergestellt. Dieser Prozess liefert Calciumcarbid, das dann gekühlt und in verschiedene Größen zur Verwendung in der Acetylenproduktion zerkleinert wird.
Acetylengas mit der chemischen Formel C₂h₂ ist ein farbloses, hochflammbares Gas mit einem ausgeprägten Knoblauchgeruch. Es ist bekannt für seine hohe Flammentemperatur und wird bei Schweißen, Schneiden und chemischer Synthese ausgiebig eingesetzt.
Die chemische Reaktion zwischen Calciumcarbid und Wasser
Die grundlegende Reaktion
Wenn Calciumcarbid mit Wasser in Kontakt kommt, wird eine Hydrolysereaktion unterzogen, wodurch Acetylengas und Calciumhydroxid erzeugt werden. Die chemische Gleichung lautet:
CAC 2(S)+2H 2O (L) → C 2H 2(G)+CA (OH) 2(aq)
- Calciumcarbid (CAC₂) reagiert mit
- Wasser (H₂o) zu produzieren
- Acetylengas (C₂h₂) und
- Calciumhydroxid (CA (OH) ₂ ₂), auch als geschlagener Kalk bekannt.
Reaktionsmechanismus
Calciumcarbid besteht aus Calciumkationen (Ca⊃2; ⁺) und Carbidanionen (C₂⊃2; ⁻). Wenn Wassermoleküle Calciumcarbid kontaktieren, reagiert das Carbidanion mit Wasser und bricht in Acetylengas und Hydroxidionen (OH⁻) zusammen. Diese Hydroxidionen kombinieren dann mit Calciumionen zu Calciumhydroxid.
Diese Reaktion ist sehr exotherm und freisetzt eine erhebliche Menge an Wärme, die in industriellen Umgebungen kontrolliert werden muss, um Gefahren zu vermeiden.
Visuelle Darstellung der Reaktion
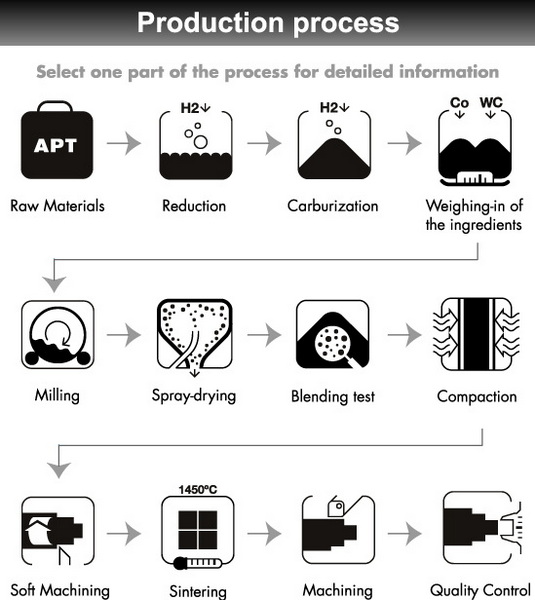
Industrieproduktion von Acetylengas aus Kalziumkarbid und Wasser
Produktionsmethoden
Es gibt zwei Hauptmethoden zur Herstellung von Acetylengas aus Calciumcarbid und Wasser:
- Nassprozess: Calciumcarbid wird in einer kontrollierten Reaktionskammer zu Wasser gegeben. Dies ist aufgrund seiner Einfachheit und Kontrollierbarkeit die am häufigsten verwendete Methode.
- Trockenprozess: Es wird eine begrenzte Menge Wasser hinzugefügt, die häufig in bestimmten Branchen wie Arzneimitteln und PVC -Herstellung verwendet wird.
Nassprozessdetails
1. Fütterung Calciumcarbid: Calciumcarbid -Granulate (typischerweise 2 mm x 8 mm) werden in eine mit Wasser gefüllte Reaktionskammer eingespeist.
2. Reaktion: Das Calciumcarbid reagiert mit Wasser und erzeugt Acetylengas und Calciumhydroxidschlamm.
3.. Gassammlung: Die Acetylengas blüht und wird durch Röhrchen gesammelt.
4. Kühlung und Reinigung: Das Gas führt durch Kondensatoren, Wäsche und Trockner, um Verunreinigungen wie Phosphin, Arsine und Feuchtigkeit zu entfernen.
5. Lagerung: Gereinigtes Acetylengas wird zum industriellen Gebrauch in Zylindern komprimiert und gespeichert.
Reaktionskontrolle und Sicherheit
- Temperaturkontrolle: Die exotherme Natur der Reaktion erfordert effiziente Kühlsysteme (Wasser- oder Luftkühlung), um sichere Betriebstemperaturen aufrechtzuerhalten.
- Druckregelung: Druckschalter regulieren die Futterrate von Calciumcarbid, um eine übermäßige Gasproduktion zu verhindern.
- Sicherheitsvorrichtungen: Blitzranger und automatische Ventile verhindern Explosionen, die durch das hochflammbare Acetylengas verursacht werden.
.
Faktoren, die die Reaktionsgeschwindigkeit und Gasausbeute beeinflussen
- Oberfläche von Calciumcarbid: Kleinerer Partikelgröße erhöht die Oberfläche und beschleunigt die Reaktion.
- Wassertemperatur: Höhere Temperaturen erhöhen die kinetische Energie und beschleunigen die Reaktion.
- Konzentration der Reaktanten: Höhere Konzentrationen von Calciumcarbid oder Wasser erhöhen die Reaktionsgeschwindigkeit.
-Wasser zu Kohlenhydratverhältnis: Die optimale Wassermenge sorgt für die maximale Acetylenausbeute ohne übermäßige Verdünnung.
Experimentelle Daten Beispiel
| Gewicht des CAC₂ (G) |
-Volumens des Wasservolumens (ML) |
Volumen von Acetylengas (ml) |
| 3 |
15 |
540 |
| 3 |
30 |
620 |
| 3 |
55 |
730 |
Anwendungen von Acetylengas, die aus Calciumcarbid erzeugt werden
Industrielle Verwendungszwecke
- Schweißen und Schneiden: Acetylen erzeugt die heißeste Flamme zwischen Brennstoffgasen (~ 3500 ° C), ideal für Oxy-Acetylen-Schweißen und Schneiden.
- Chemische Synthese: Wird als Vorläufer für die Herstellung von Kunststoffen (PVC, Polyethylen), synthetischer Gummi, Essigsäure und verschiedene organische Chemikalien verwendet.
- Beleuchtung: Historisch gesehen in Carbidlampen für Bergbau und tragbare Beleuchtung verwendet.
- Wärmebehandlung: Bietet eine kontrollierte Flamme für Metallwärmebehandlungsprozesse.
Andere Verwendungen
- Metallentschwefelung: Calciumcarbid reagiert mit Schwefelverunreinigungen in geschmolzenem Stahl, um die Stahlqualität zu verbessern.
- Laborverwendungen: Acetylen wird in der organischen Chemie zur Synthese von Acetylenderivaten verwendet.
Sicherheitsüberlegungen in der Acetylenproduktion
- Wärmebehandlung: Überschüssige Wärme aus der Reaktion kann Geräteschäden oder Explosionen verursachen, wenn sie nicht ordnungsgemäß kontrolliert werden.
- Verunreinigungen: Phosphin- und Arginverunreinigungen sind toxisch; Reinigung ist kritisch.
- Speicherung: Acetylenzylinder müssen in gut belüfteten Bereichen, weg von Zündquellen und bei kontrollierten Temperaturen gelagert werden.
- Handhabung: Die Verwendung von Flash -Arrestoren und Druckregulatoren ist obligatorisch, um Unfälle zu verhindern.
Umweltauswirkungen und Nachhaltigkeit der Acetylenproduktion
Die Produktion von Acetylengas aus Kalziumkarbid und Wasser hat Umweltüberlegungen, die die Branchen ansprechen müssen. Der Prozess erzeugt Calciumhydroxid als Nebenprodukt, das auf verschiedene Arten zur Minimierung von Abfällen verwaltet und verwendet werden kann. Die ordnungsgemäße Entsorgung oder Recycling von Calciumhydroxid ist wichtig, um die Umweltverschmutzung zu verhindern.
Darüber hinaus trägt die energieintensive Produktion von Calciumcarbid selbst, die hohe Temperaturen und einen signifikanten Stromverbrauch erfordert, zum CO2-Fußabdruck der Acetylenproduktion bei. Fortschritte in der Technologie zielen darauf ab, die Energieeffizienz zu verbessern und die Emissionen während der Calciumcarbidherstellung zu verringern.
Branchen nehmen zunehmend umweltfreundlichere Technologien ein, beispielsweise die Verwendung erneuerbarer Energiequellen zur Stromversorgung elektrischer Lichtbogenöfen und das Recycling von Calciumhydroxid -Nebenprodukten in der Landwirtschaft und im Bau, bei denen sie als Bodenkonditionierer oder Zementadditiv dienen kann.
Innovationen und zukünftige Trends in der Acetylenproduktion
Die Forschung optimiert weiterhin die Produktion von Acetylengas aus Calciumcarbid und Wasser. Zu den Innovationen zählen die Entwicklung von Katalysatoren zur Verbesserung der Reaktionsraten, verbesserte Reaktorkonstruktionen für ein besseres Wärmemanagement und die Automatisierung zur Steigerung der Sicherheit und Effizienz.
Darüber hinaus werden alternative Methoden zur Acetylenproduktion wie aus Erdgas oder Biomasse untersucht, um nachhaltigere und kostengünstigere Optionen zu bieten. Die Calciumcarbid-Wasser-Reaktion bleibt jedoch aufgrund ihrer Einfachheit und Wirksamkeit eine zuverlässige und weit verbreitete Methode.
Emerging Technologies konzentrieren sich auf miniaturisierte Acetylengeneratoren für die Produktion vor Ort, die die Transportrisiken und -kosten senken. Automatisierungs- und digitale Überwachungssysteme tragen auch dazu bei, optimale Reaktionsbedingungen aufrechtzuerhalten und die Ertrag und Sicherheit zu verbessern.
Fehlerbehebung gemeinsame Probleme bei der Acetylenproduktion
Die Betreiber stehen häufig vor Herausforderungen wie inkonsistenten Gasertrag, Verunreinigungen des Gas und der Korrosion der Ausrüstung. Die Behebung dieser Probleme beinhaltet regelmäßige Wartung, Qualitätskontrolle von Rohstoffen und die Überwachung der Reaktionsbedingungen eng.
Beispielsweise können Verunreinigungen wie Phosphin und Arsine durch Verwendung von Calciumcarbid und effektiven Gas-Scrubbing-Systemen mit hohem Purity reduziert werden. Korrosion, die durch Calciumhydroxid-Aufschlämmung verursacht wird, erfordert korrosionsbeständige Materialien in der Reaktionskammer.
Weitere häufige Probleme sind das Verstopfen von Futtersystemen aufgrund von Feuchtigkeit oder Carbidstaub, die durch ordnungsgemäße Lagerung und Handhabung von Calciumcarbid gemindert werden können. Die Überwachung der Reaktion und des Drucks hilft, außer Kontrolle geratene Reaktionen oder unvollständige Gaserzeugung zu verhindern.
Zusammenfassung der wichtigsten Punkte
- Calciumcarbid reagiert mit Wasser, um Acetylengas und Calciumhydroxid zu erzeugen.
- Die Reaktion ist exotherm und erfordert eine sorgfältige Temperatur und Druckregelung.
- Acetylengas hat unterschiedliche industrielle Anwendungen, insbesondere bei Schweißen und chemischer Synthese.
- Umwelt- und Sicherheitsüberlegungen sind im Produktionsprozess von entscheidender Bedeutung.
- Laufende Innovationen zielen darauf ab, die Effizienz und Nachhaltigkeit zu verbessern.
Abschluss
Die Reaktion von Calciumcarbid mit Wasser zur Herstellung von Acetylengas ist ein chemischer Eckpfeiler mit einer erheblichen industriellen Bedeutung. Diese exotherme Hydrolysereaktion liefert Acetylengas und Calciumhydroxid, die für die Branche Schweißen, Schneiden und chemische Herstellung von wesentlicher Bedeutung sind.

Häufig gestellte Fragen (FAQ)
1. Welche Sicherheitsvorkehrungen sollten beim Umgang mit Calciumcarbid und Acetylengas getroffen werden?
Der Umgang mit Kalziumkarbid erfordert eine trockene Lagerung, um eine vorzeitige Reaktion mit Feuchtigkeit zu verhindern. Während der Acetylenproduktion müssen Temperatur und Druck kontrolliert werden, und es sollten Flash -Arrestoren installiert werden, um Explosionen zu verhindern. Acetylengaszylinder müssen in belüfteten Bereichen außerhalb von Zündquellen aufrecht gelagert werden.
2. Kann Acetylengas ohne Kalziumkarbid hergestellt werden?
Ja, Acetylen kann auch durch die partielle Verbrennung von Methan oder durch Knacken von Kohlenwasserstoffen in petrochemischen Prozessen erzeugt werden. Die Calciumcarbid-Wasser-Reaktion bleibt jedoch eine einfache und kostengünstige Methode, insbesondere wenn Calciumcarbid leicht verfügbar ist.
3. Wie ist die Reinheit von Acetylengas gewährleistet?
Die Reinheit wird durch Verwendung hochwertiger Calciumcarbid, Kontrolle der Reaktionsparameter und der Durchführung des Gases durch Wäsche und Trockner sichergestellt, um Verunreinigungen wie Phosphin, Arsine und Feuchtigkeit zu entfernen.
4. Was passiert mit dem in der Reaktion erzeugten Calciumhydroxid?
Calciumhydroxid, auch als schlager Kalk bezeichnet, kann sicher oder recycelt werden. Es wird in der Landwirtschaft zur Neutralisierung saurer Böden, im Konstruktion als Bestandteil des Zements und in der Wasserbehandlung verwendet.
5. Warum wird Acetylengas für das Schweißen über andere Gase bevorzugt?
Acetylen erzeugt die heißeste Flamme bei häufig verwendeten Brennstoffgasen und erreicht in Kombination mit Sauerstoff die Temperaturen um 3500 ° C. Diese hohe Temperatur ermöglicht ein effizientes Schneiden und Schweißen von Metallen.
Zitate:
[1] https://melscience.com/us-en/articles/chemical-characteristics-calcium-carbide-and-its-r/
[2] https://www.ijsrd.com/articles/ijsrdv8i30699.pdf
[3] https://www.acetyleneplant.net/technology/applications-of-acetylen-gas/
[4] https://www.tjtywh.com/how-to-ensure-safety-cetylene-production-vergas-Calcium-carbide.html
[5] http://enggyd.blogspot.com/2012/03/acetylene-production-process-using.html
[6] https://www.alzchem.com/en/company/news/calcium-carbide-for-acetylene-production/
[7] https://www.doubtnut.com/qna/452591445
[8] https://www.tjtywh.com/a-VERSTANDING-THE-ROLE-ANCE-CALCIUM-CARBIDE-IN-ACETYLENE-PROODUKTION.HTML
[9] https://rexarc.com/blog/know-how-acetylen-is-produced-in-cetylen-plant/
[10] https://www.tjtywh.com/a- the-reaction-of-calcium-carbide-with-water-verständnis-the-chemistry-behind-it.html
[11] http://www.crecompany.com/company_news_en/calcium-carbide278.html
[12] https://www.tjtywh.com/a- the-nes-and-productionof-acetylen-calcium-carbide.html
[13] https://www.tjtywh.com/a-VERSTANDING-THE-REACTICTICT-OF-CALCIUM-CARBIDE-IN-WASTER.HTML
[14] https://www.kviconline.gov.in/pmegp/pmegpweb/docs/commonprojectProfile/acetylenegas.pdf
[15] https://www.tjtywh.com/a-VERSIONSINGING-THEACTICTICT-OF-CALCIUM-CARBIDE-IN-WATER-THE-SCIENCE-BEHIND-THE-REACTICT.HTML
[16] https://www.youtube.com/watch?v=rctb0l7uuli
[17] https://www.tiktok.com/@chemicalkim/video/7010 16965429132 0070
[18] https://www.youtube.com/watch?v=jgb4-rdypym
[19] https://rexarc.com/blog/calcium-carbide-for-acetylen-production/
[20] https://www.acetylenegasplant.com/applications.php
[21] https://www.tjtywh.com/how-to-safely-transport-and-store-calcium-carbide.html
[22] https://www.sciencesource.com/2418691-calcium-carbide-reacts-with-water-stock-video-rights- managed.html
[23] https://chemed.chem.purdue.edu/demos/demosheets/24.9.html
[24] https://www.acs.org/education/whatischemistry/landmarks/calciumcarbidacetylen.html
[25] https://air-source.com/blog/8-interesting-uses-for-acetylen/
[26] https://nj.gov/health/eoh/rtkweb/documents/fs/0312.pdf
[27] https://melscience.com/us-en/articles/hydrolyse-calcium-carbide-characteristic-sub/
[28] https://www.alamy.com/stock-photo/calcium-carbide-water.html
[29] https://www.shutterstock.com/search/calcium-carbide
[30] https://sciencesource.com/2449645-calcium-carbide-reacts-with-water-3-of-3-stock-image-rights- managed.html
[31] https://ocw.mit.edu/courses/22-033-nuclear-System-design-project-fall-2011/4a2d1059fade1cCE993AFC56D35E42D_MIT22_033F11_LEC07_NOT.PDF
[32] https://www.acetylenegasplant.com/photo-gallery.php
[33] https://www.gettyimages.com/photos/calcium-carbide
[34] https://www.shutterstock.com/image-photo/calcium-carbide-cac2-water-reacts-on-2041401479
[35] https://rexarc.com/blog/know-how-acetylen-isproduced-in-cetylen-plant/
[36] https://en.wikipedia.org/wiki/calcium_carbide
[37] https://www.istockphoto.com/photos/metal-gas-cuting-with-acetylene-torch
[38] https://www.istockphoto.com/photos/calcium-carbide
[39] https://stock.adobe.com/search?k=%22calcium+Carbide%22
[40] https://www.tjtywh.com/common-faqs-about-calcium-carbide-10-key-questions-customers-care-about.html
[41] https://camachem.com/es/blog/post/frequent-hornd-question-about-calcium-carbide
[42] https://www.labour.gov.hk/eng/public/os/b/welting2.pdf
[43] https://sathee.prutor.ai/article/chemistry/chemistry-calcium-carbide/
[44] https://www.nexair.com/learning-center/industrial-uses-of-acetylen/
[45] https://www.eiga.eu/uploads/documents/doc226.pdf
[46] https://www.vedantu.com/question-answer/calcium-carbide-reacts-with-water-to-produce-a-class-11-chemistry-cbse-5f087ebf832a2662986672f0
[47] https://www.energy.virginia.gov/mineral-ming/documents/training/refresher/maintenannerpairtopics/ar-oxygen-acetyleneusandafety.pdf
[48] https://www.hse.gov.uk/fireandexplosion/acetylen.htm
[49] https://www.sciencedirect.com/science/article/abs/pii/s0959652621032443
[50] https://cdn.intratec.us/docs/reports/previews/acetylen-e31a-b.pdf
[51] https://www.sciencedirect.com/science/article/pii/s2369969820300608
[52] https://iigas.com/usses-ocetylene-gas/
[53] https://www.youtube.com/watch?v=aihksObcluu
[54] https://www.studocu.com/en-za/messages/question/8961294/a-conclusion-for-experiment-ofreparation-paration-testing-ocetlee-from-calcium-carbide-and-water
[55] https://cdn.intratec.us/docs/reports/previews/acetylen-e11a-b.pdf
[56] https://melscience.com/us-en/articles/chemical-characteristics-calcium-carbide-tit-it-r/
[57] https://www.sciencedirect.com/science/article/pii/s2468025722001820
[58] https://www.youtube.com/watch?v=ovcyzwvykvo
[59] https://www.tjtywh.com/a-instanding-the-reaction-of-calcium-carbide-in-wasser.html
[60] https://www.alamy.com/stock-photo/calcium-reaction-water.html
[61] https://www.acetyleneplant.net/technology/process-description-of-acetylen-plant/
[62] https://www.istockphoto.com/photos/acetylen-cylinder
[63] https://www.cdhfineechical.com/images/product/msds/51_130617646_calciumcarbide-casno-75-20-7-7-msds.pdf
[64] https://www.bocgasen.co.uk/files/facts_about_acetylen.pdf
[65] https://www.flinnsci.ca/api/library/download/877039d923ef426f961d5438aae85EB6
[66] https://eg.airliquide.com/oxygen-and-cetylen-esessentials
[67] https://www.airproducts.com.hk/gasen/acetylene
[68] https://testbook.com/question-ananswer/which-gas-is-evolved-when-water-is-added-to-calciu-612cb8db1c0d7fc68e81669b
















