Innholdsmeny
● Introduksjon til wolframkarbid
>> Kjemisk struktur
● Egenskaper til wolframkarbid
>> Fysiske egenskaper
>> Kjemiske egenskaper
● Bruksområder av wolframkarbid
>> Industrielle applikasjoner
>> Ikke-industrielle applikasjoner
● Er tungsten karbidionisk?
>> Binding natur
● Produksjon og prosessering
● Miljø- og helsehensyn
>> Miljøpåvirkning
>> Helserisiko
● Konklusjon
● FAQ
>> 1. Hva er den kjemiske formelen for wolframkarbid?
>> 2. Hvordan syntetiseres wolframkarbid?
>> 3. Hva er de primære anvendelsene av wolframkarbid?
>> 4. Er wolframkarbidresistent mot korrosjon?
>> 5. Hvilken type binding viser wolframkarbid?
● Sitasjoner:
Tungsten -karbid, med den kjemiske formelen WC, er en forbindelse som består av wolfram- og karbonatomer. Det er kjent for sin eksepsjonelle hardhet og holdbarhet, noe som gjør det til et avgjørende materiale i forskjellige industrielle applikasjoner, inkludert skjæreverktøy og slitasjebestandige deler. Imidlertid spørsmålet om Tungsten -karbid er en ionisk forbindelse krever forståelse av dens kjemiske struktur og bindende natur.

Introduksjon til wolframkarbid
Wolframkarbid syntetiseres ved å reagere wolfram med karbon ved høye temperaturer, typisk mellom 1400 ° C og 2000 ° C. Den resulterende forbindelsen har en sekskantet krystallstruktur, der wolframatomer danner et gitter og karbonatomer fyller mellomrommene. Denne strukturen er karakteristisk for interstitielle karbider, som dannes av overgangsmetaller som wolfram.
Kjemisk struktur
Den kjemiske strukturen til wolframkarbid er ikke typisk for ioniske forbindelser, som vanligvis involverer overføring av elektroner mellom atomer for å danne ioner. I stedet viser wolframkarbid kovalent eller mellomliggende binding, der karbonatomer opptar mellomrommene i et wolframgitter. Denne typen bindinger er vanlig i overgangsmetallkarbider og bidrar til deres hardhet og stabilitet.
Tungsten-karbidens krystallstruktur blir ofte beskrevet som et sekskantet nærpakket (HCP) arrangement av wolframatomer med karbonatomer i de oktaedriske mellomtallene. Dette arrangementet maksimerer pakningseffektiviteten og bidrar til forbindelsens høye tetthet og hardhet.
Egenskaper til wolframkarbid
Tungsten -karbid er kjent for sitt høye smeltepunkt, hardhet og motstand mot korrosjon. Disse egenskapene gjør det ideelt for applikasjoner i skjæreverktøy, slitasjebestandige deler og til og med smykker.
Fysiske egenskaper
- Smeltingspunkt: Tungsten -karbid har et smeltepunkt på omtrent 2 870 ° C, som er blant de høyeste for noe materiale.
- Hardhet: Det rangerer omtrent 9 på Mohs -skalaen, noe som gjør det til et av de vanskeligste stoffene som er kjent, bare for å diamant.
- Termisk ledningsevne: Den viser en høy termisk ledningsevne, noe som er gunstig for å spre varme i høye temperaturapplikasjoner.
Kjemiske egenskaper
- Korrosjonsbestandighet: Wolframkarbid er resistent mot de fleste syrer, men kan reagere med hydrofluorsyre og fluorgass.
- Oksidasjon: Det begynner å oksidere ved temperaturer rundt 500 ° C til 600 ° C.
Bruksområder av wolframkarbid
Gitt sine eksepsjonelle egenskaper, er wolframkarbid mye brukt i forskjellige bransjer:
Industrielle applikasjoner
- Skjæreverktøy: Tungsten -karbid brukes i borbiter, sagblader og andre skjæreverktøy på grunn av dets hardhet og slitasje.
- Slitasjebestandige deler: Det brukes i deler som krever høy holdbarhet, for eksempel i gruvedrift og anleggsutstyr.
Ikke-industrielle applikasjoner
- Smykker: Wolframkarbid brukes også i smykker på grunn av dets hardhet og motstand mot riper.
- Medisinske verktøy: Dens holdbarhet gjør det egnet for visse medisinske instrumenter.
I tillegg til disse bruksområdene, brukes wolframkarbid i rakettdyser og andre høye temperaturkomponenter på grunn av dens evne til å motstå ekstreme temperaturer uten nedbrytning.

Er tungsten karbidionisk?
For å avgjøre om wolframkarbid er en ionisk forbindelse, må vi forstå arten av dens kjemiske bindinger. Ioniske forbindelser dannes når det er en signifikant forskjell i elektronegativitet mellom de involverte atomene, noe som fører til overføring av elektroner og dannelse av ioner. I kontrast dannes wolframkarbid gjennom mellomliggende binding, der karbonatomer passer inn i mellomrommene i et wolframgitter uten betydelig elektronoverføring.
Binding natur
Bindingen i wolframkarbid er mer beslektet med kovalent eller mellomliggende binding i stedet for ionisk. Dette er typisk for overgangsmetallkarbider, der karbonatomene inntar spesifikke posisjoner i metallgitteret, og bidrar til forbindelses hardhet og stabilitet.
Produksjon og prosessering
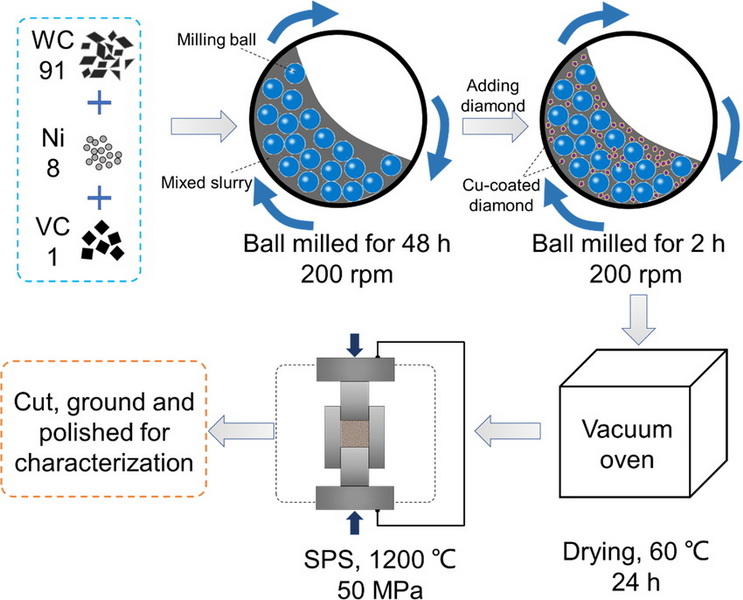
Produksjonen av wolframkarbid innebærer typisk reaksjon av wolframmetall med karbon i form av grafitt eller karbon svart. Denne prosessen utføres ofte i en ovn med høy temperatur. Det resulterende karbidpulveret kan deretter konsolideres ved bruk av forskjellige teknikker, for eksempel sintring eller varm isostatisk pressing (hofte), for å danne ønsket form og struktur.
Sementert karbid, en vanlig form for wolframkarbid, produseres ved å blande wolframkarbidpulver med et bindemiddelmetall, typisk kobolt og deretter sintring av blandingen. Kobolt fungerer som et bindemiddel, holder wolframkarbidkornene sammen og gir seighet til materialet.
Miljø- og helsehensyn
Mens wolframkarbid generelt anses som trygt når det brukes riktig, er det miljømessige og helsehensyn knyttet til dens produksjon og avhending. Gruvedrift av wolfram kan ha miljøpåvirkninger, og eksponering for wolframkarbidstøv under prosessering kan utgjøre helserisiko.
Miljøpåvirkning
Ekstraksjonen av wolfram innebærer ofte gruvedrift med åpen grop, noe som kan føre til jorderosjon og vannforurensning hvis det ikke administreres ordentlig. I tillegg bidrar den høye energien som kreves for produksjon av wolframkarbid til klimagassutslipp.
Helserisiko
Innånding av volframkarbidstøv kan forårsake luftveisproblemer. Derfor er det avgjørende å iverksette riktige sikkerhetstiltak under håndtering og prosessering.
Konklusjon
Tungsten -karbid er ikke en ionisk forbindelse, men viser heller mellomliggende eller kovalent binding. Dens unike egenskaper gjør det uvurderlig i forskjellige industrielle og ikke-industrielle applikasjoner. Å forstå den kjemiske strukturen og bindingskarpen er avgjørende for å sette pris på bruken og begrensningene.
FAQ
1. Hva er den kjemiske formelen for wolframkarbid?
Wolframkarbid har den kjemiske formelen WC, bestående av like deler av wolfram- og karbonatomer.
2. Hvordan syntetiseres wolframkarbid?
Wolframkarbid syntetiseres ved oppvarming av wolfram med karbon ved høye temperaturer, typisk mellom 1400 ° C og 2000 ° C.
3. Hva er de primære anvendelsene av wolframkarbid?
Tungsten-karbid brukes først og fremst i skjæreverktøy, slitasjebestandige deler og smykker på grunn av dens hardhet og holdbarhet.
4. Er wolframkarbidresistent mot korrosjon?
Ja, wolframkarbid er resistent mot de fleste syrer, men kan reagere med hydrofluorsyre og fluorgass.
5. Hvilken type binding viser wolframkarbid?
Wolframkarbid viser interstitiell eller kovalent binding snarere enn ionisk binding.
Sitasjoner:
[1] https://en.wikipedia.org/wiki/tungsten_carbide
[2] https://hpvchemicals.oecd.org/ui/handler.axd?id=ed1c76bf-dad9-4baa-8d1b-70fed7f92862
[3] https://www.allied-material.co.jp/en/techinfo/tungsten_carbide/features.html
[4] http://www.tungsten-carbide.com.cn
[5] https://www.linde-amt.com/resource-library/articles/tungsten-carbide
[6] https://www.carbideprobes.com/wp-content/uploads/2019/07/tungstencarbidedatasheet.pdf
[7] https://www.alamy.com/stock-photo/tungsten-carbide.html
[8] https://www.britannica.com/science/tungsten-carbide
[9] https://www.vedantu.com/chemistry/carbide
[10] https://en.wikipedia.org/wiki/carbide
















