Indholdsmenu
● Hvad definerer et netværk solidt?
>> Nøgleegenskaber ved netværksstoffer
● Atomstruktur af wolframcarbid
>> 1. hexagonal (α-WC) struktur
>> 2. Kubisk (ß-WC) struktur
>> Bindingskarakteristika: Kovalent vs. Metallic
● Fysiske og kemiske egenskaber
>> Termisk og kemisk stabilitet
● Syntese og fremstilling
>> 1. pulverproduktion
>> 2. sintring
● Anvendelser, der udnytter netværksstruktur
>> 1. skære- og boreværktøjer
>> 2. slidbestandige belægninger
>> 3. høj temperaturkomponenter
>> 4. forbrugerprodukter
● Sammenlignende analyse: WC vs. andre netværksstoffer
>> Ligheder
>> Forskelle
● Konklusion
● FAQ
>> 1. Er wolframcarbid en keramik eller et metal?
>> 2. Hvorfor udfører Wolframcarbid elektricitet på trods af at være et netværksstof?
>> 3. Hvordan sammenligner wolframcarbides hårdhed med Diamond?
>> 4. Hvilke industrier er mest afhængige af wolframcarbid?
>> 5. Hvordan syntetiseres wolframcarbid?
● Citater:
Wolframcarbid (WC) er en keramisk sammensat, der er kendt for sin ekstraordinære hårdhed, høje smeltepunkt og industriel alsidighed. Dens unikke atomstruktur og bindingsegenskaber har givet anledning til debatter om dens klassificering som et netværksstof. Denne artikel udforsker sine strukturelle egenskaber, sammenligner den med klassiske netværksstoffer som Diamond, undersøger sine syntesemetoder og adresserer almindelige spørgsmål om dens opførsel og applikationer.
Hvad definerer et netværk solidt?
Netværksstoffer, også kaldet kovalente netværksstoffer, er materialer, hvor atomer er forbundet med kovalente bindinger i en kontinuerlig tredimensionel gitter. Disse strukturer mangler diskrete molekyler og udviser høje smeltepunkter, stivhed og dårlig elektrisk ledningsevne på grund af lokaliserede elektroner. Klassiske eksempler inkluderer:
- Diamond: En tetrahedral kulstofgitter (figur 1A).
- Quartz (SiO₂): En ramme for silicium-ilt tetrahedra.
- Siliciumcarbid (SIC): En diamantlignende struktur med skiftevis silicium- og carbonatomer.
Nøgleegenskaber ved netværksstoffer
- Høje smeltepunkter (f.eks. Diamond underplads ved 3.500 ° C).
- Ekstraordinær hårdhed på grund af stive kovalente bindinger.
- Lav elektrisk ledningsevne (undtagen grafit, der har delokaliseret π-elektroner).
- sprød natur med minimal plastdeformation under stress.
Atomstruktur af wolframcarbid
Wolframcarbid krystalliserer i to primære former med forskellige bindingsmønstre:
1. hexagonal (α-WC) struktur
Den termodynamisk stabile a-fase vedtager en simpel hexagonal gitter (figur 1B):
- Wolframatomer danner tætpakkede lag.
- Carbonatomer optager 50% af de trigonale prismatiske interstater, hvilket skaber et WC -forhold på 1: 1.
- Hver wolframatombindinger binder kovalent til seks kulstof naboer (bindingslængde: 220 pm).
Dette arrangement ligner et 3D-kovalent netværk, der ligner diamant, men med vekslende metal-kulstoflag.
2. Kubisk (ß-WC) struktur
Den metastabile ß-fase har en klippesalt (NaCl) struktur:
- Wolfram- og carbonatomer besætter skiftende ansigtscentrerede kubiske positioner.
- Denne fase dannes over 2.500 ° C, men konverterer hurtigt til a-WC ved afkøling.
Bindingskarakteristika: Kovalent vs. Metallic
Mens kovalente obligationer dominerer i a-WC, dukker der op med subtile metalliske træk:
- Delvis elektron-delokalisering: Overlappende D-orbitaler af wolfram tillader begrænset elektronmobilitet, hvilket giver elektrisk resistivitet (~ 0,2 μΩ · m) tættere på metaller end keramik.
- Duktilitet i kompositter: Pure WC er sprødt, men tilføjelse af kobolt (CO) -bindere muliggør plastdeformation under stress.
Fysiske og kemiske egenskaber
Wolframcarbid udviser en blanding af keramiske og metalliske egenskaber:
| Property |
Tungsten Carbide |
Diamond |
Steel (AISI 1045) |
| Hårdhed (Mohs) |
9.0–9.5 |
10 |
4–4,5 |
| Smeltepunkt (° C) |
2.870 |
3.500 (sublimer) |
1.425–1.520 |
| Elektrisk resistivitet (μΩ · m) |
0.2 |
~ 10⊃1; ⊃2; |
0.15 |
| Termisk ledningsevne (w/m · k) |
110 |
900–2.300 |
50 |
| Trykstyrke (GPA) |
6.76 |
110 |
0,25–0,35 |
Termisk og kemisk stabilitet
- Oxidationsmodstand: stabil i luft op til 500–600 ° C; Formularer wo₃ og co₂ over 600 ° C.
- Syrebestandighed: Inert til hydrochlorisk og svovlsyrer, men opløses i HF/HNO₃ -blandinger.
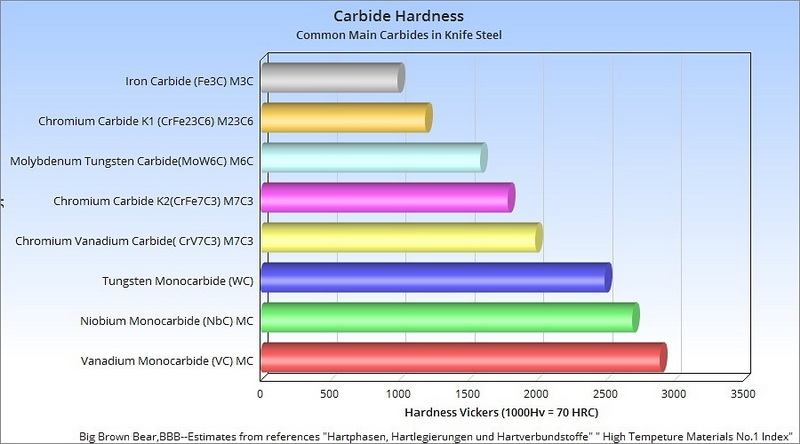
Syntese og fremstilling
Wolframcarbid syntetiseres i to trin:
1. pulverproduktion
- Direkte karburisering: Wolframpulver reagerer med carbon sort ved 1.400–2.000 ° C:
W+CΔWC
-Gasfasemetoder: Kemisk dampaflejring (CVD) skaber ultra-fine WC-pulvere til belægninger.
2. sintring
Pulvere blandes med kobolt (3-30 vægt%) og sintres ved 1.300–1.500 ° C for at danne tætte kompositter (figur 2). Kobolt fungerer som et bindemiddel, der fylder huller mellem WC -korn og forbedrer sejhed.
Anvendelser, der udnytter netværksstruktur
Wolframcarbides kovalente gitter understøtter sin industrielle dominans:
1. skære- og boreværktøjer
- WC-CO-kompositter dominerer bearbejdningsindustrien.
- Overlegen slidstyrke muliggør højhastighedsskæring af legeringer og kompositter (figur 3).
2. slidbestandige belægninger
-Sprøjtningsaflejringer med høj hastighed iltbrændstof (HVOF) til WC-Co-belægninger på rumfartskomponenter.
- Diamond-lignende carbon (DLC) belægninger med WC-nanopartikler Forbedrer bilens dele.
3. høj temperaturkomponenter
- Raketdyseforinger: WCs termiske stabilitet tåler fremdriftsudstødning (> 2.000 ° C).
- Atomreaktorskærme: WC-B₄C-kompositter blokerer neutronstråling.
4. forbrugerprodukter
- Smykker: Sinterede WC -ringe modstår ridser bedre end platin eller guld.
- Sportsvarer: WC-Tippede golfklubber og cykelpedaler forbedrer holdbarheden.
Sammenlignende analyse: WC vs. andre netværksstoffer
Ligheder
- 3D -kovalent binding definerer strukturel integritet.
- Modstår høje hårdhedsdeformation af plast.
Forskelle
- Elektrisk ledningsevne: WC udfører elektricitet; Diamond og kvarts gør det ikke.
- Fraktur sejhed: WC-CO-kompositter (10-20 MPa√m) overgår diamant (5-10 MPa√m).
Konklusion
Wolframcarbid kvalificerer sig som et netværksstof på grund af dets sammenkoblede kovalent gitter. Imidlertid udfordrer dens elektriske ledningsevne og tilpasningsevne i metallisk niveau i sammensat form traditionelle keramiske klassifikationer. Disse dobbelte træk - rodfæstet i dens atomstruktur og fremstillingsinnovationer - gør det uundværligt i brancher, der kræver ekstrem holdbarhed og præcision.

FAQ
1. Er wolframcarbid en keramik eller et metal?
Wolframcarbid er en keramik med kovalent binding. Imidlertid er det ofte kombineret med metalliske bindemidler som Cobalt til dannelse af Cermets, der udviser hybridegenskaber.
2. Hvorfor udfører Wolframcarbid elektricitet på trods af at være et netværksstof?
Dens hexagonale gitter tillader delvis elektron -delokalisering, svarende til grafit. Overlapningen af Wolframs D-orbitaler letter elektronmobilitet og giver resistivitet svarende til metaller.
3. Hvordan sammenligner wolframcarbides hårdhed med Diamond?
WC (MOHS 9.0–9.5) er lidt blødere end Diamond (MOHS 10), men sværere end Corundum (Sapphire/Ruby).
4. Hvilke industrier er mest afhængige af wolframcarbid?
Minedrift, rumfart og fremstilling bruger WC til skæreværktøjer, slidbestandige belægninger og høje temperaturkomponenter.
5. Hvordan syntetiseres wolframcarbid?
WC -pulver produceres via direkte karburisering af wolframmetal ved 1.400–2.000 ° C. Sintring med koboltbindere skaber tætte kompositter.
Citater:
[1] https://en.wikipedia.org/wiki/tungsten_carbide
[2] https://www.vedantu.com/chemistry/tungsten-carbide
[3] https://scienceinfo.com/tungsten-carbide-droperties-applications/
[4] https://www.istockphoto.com/photos/tungsten-carbide
[5] http://www.chinatungsten.com/tungsten-carbide/properties-of-tungsten-carbide.html
[6] https://www.linde-amt.com/resource-library/articles/tungsten-carbide
[7] https://www.refractorymetal.org/tungsten-carbide-usse-droperties.html
[8] https://www.freepik.com/free-fotos-vectors/tungsten-carbide
[9] https://en.wikipedia.org/wiki/file:-alpha_tungsten_carbide_crystal_structure.jpg
[10] https://lodricrouxmatsci.wordpress.com/35-2/
[11] https://www.doubtnut.com/qna/12974648
[12] http://www.tungsten-carbide.com.cn
[13] https://periodictable.com/elements/074/pictures.html















